苦情・副作用報告の効率的処理:AIによるトリアージと分析
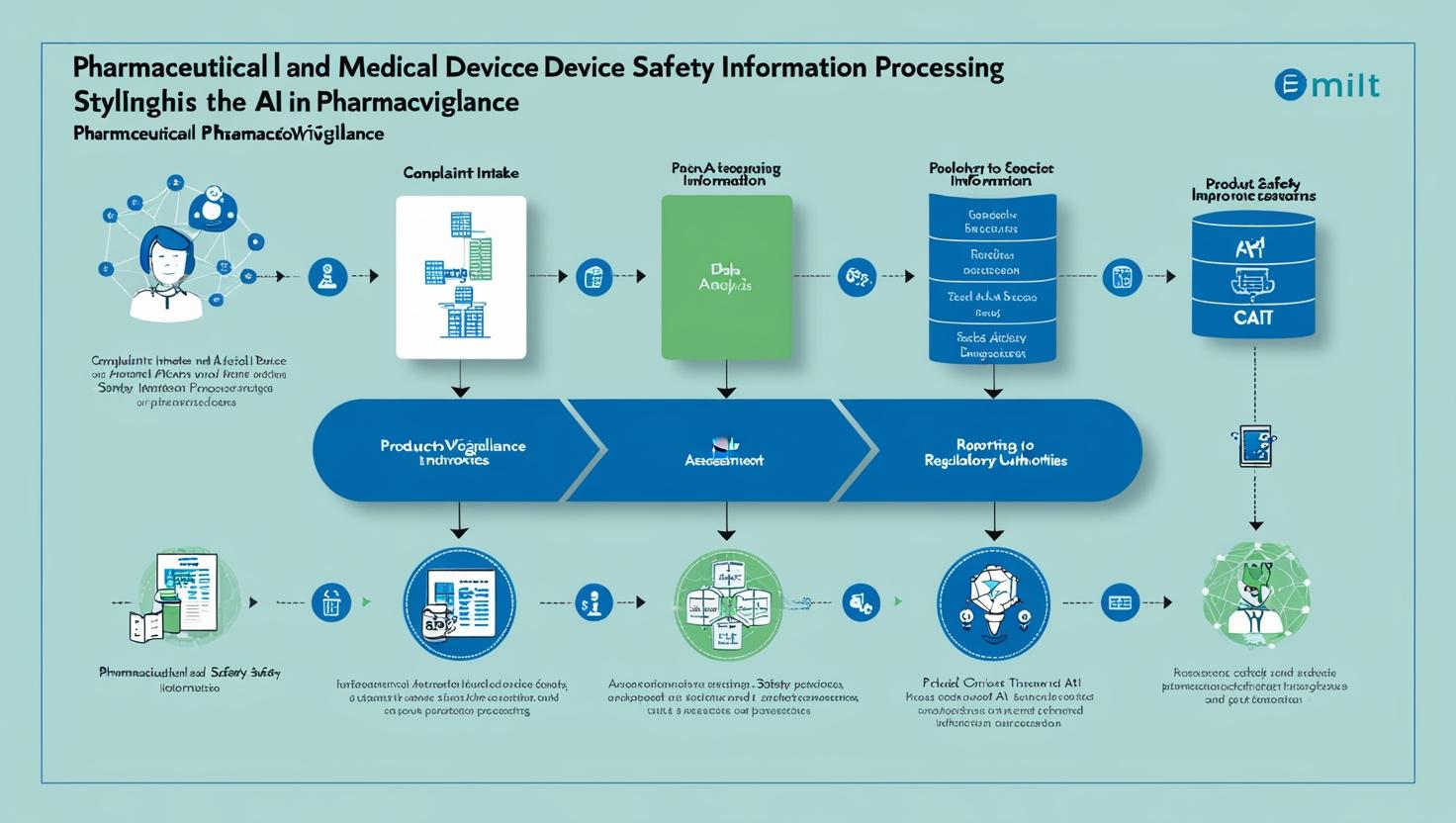
安全性情報の収集・分析・報告におけるAI活用法
はじめに
医薬品・医療機器業界において、患者安全性の確保は最も重要な責務である。苦情・副作用報告(以下、安全性情報)の適切な処理は、製品の安全性プロファイルを維持し、規制当局への報告義務を果たすうえで不可欠である。近年、AI(人工知能)技術の革新により、従来の安全性監視(ファーマコビジランス)業務に大きな変革がもたらされている。本コラムでは、安全性情報処理の基本的な流れとAI活用の実際について、専門用語を交えながらも分かりやすく解説する。
安全性情報処理の基本フロー
1. 情報収集(Information Collection)
安全性情報は多様なソースから収集される。医療従事者からの直接報告、患者・消費者からの苦情、文献報告、規制当局からの情報などが主要な情報源となる。これらの情報は、構造化データと非構造化データの両方で提供されることが多い。
2. 初期評価・トリアージ(Initial Assessment & Triage)
収集された情報について、緊急性や重要度を判定し、処理の優先順位を決定するプロセスである。この段階では、有効性情報なのか安全性情報なのかの判別、重篤性の評価、因果関係の初期判定などが行われる。
3. 詳細調査・評価(Detailed Investigation & Assessment)
医学的評価、症例の妥当性確認、因果関係評価などの詳細な安全性評価を実施する。WHOのADR因果関係評価基準やNaranjoスケールなどの標準化された手法が用いられる。
4. 規制報告(Regulatory Reporting)
評価結果に基づき、各国規制当局への報告を行う。PSUR(定期的安全性最新報告)、DSUR(開発期間中安全性最新報告)、個別症例安全性報告(ICSR: Individual Case Safety Report)などの形式で報告される。
AI技術の安全性情報処理への適用
自然言語処理(NLP)による情報抽出
Named Entity Recognition(NER)技術を活用することで、非構造化テキストから重要な医学的情報を自動抽出できる。
- 薬剤名抽出: 医薬品名、一般名、商品名の識別と正規化
- 有害事象抽出: 症状、疾患名、検査値異常の自動検出
- 患者属性抽出: 年齢、性別、併用薬、既往歴の構造化
Medical Codingでは、MedDRA(Medical Dictionary for Regulatory Activities)への自動コーディングが可能である。機械学習アルゴリズムにより、報告された症状を適切なPreferred Term(PT)やSystem Organ Class(SOC)に分類する。
機械学習による重篤性判定とトリアージ
分類アルゴリズムを用いて、報告の重篤性や緊急性を自動判定できる。
- 重篤性分類: ICH E2A定義に基づく重篤な有害事象の自動識別
- 緊急性評価: 報告の処理優先度を決定する機械学習モデル
- 症例完整性評価: 報告に含まれる情報の完整性や妥当性の自動チェック
Random ForestやGradient Boostingなどのアンサンブル学習手法により、複数の要因を総合的に判断した高精度な分類が実現される。
深層学習による因果関係評価
Transformerモデルを基盤とした手法では、文脈情報を考慮した高度な因果関係評価が可能である。
- 時系列分析: 薬剤投与と有害事象発現のタイミング関係の評価
- 症状パターン認識: 既知の副作用プロファイルとの類似性評価
- 薬理学的妥当性: 薬剤の作用機序と有害事象の生物学的関連性の判定
シグナル検出とトレンド分析
時系列解析と異常検知技術を組み合わせることで、新たな安全性シグナルの早期発見が可能となる。
- Disproportionality Analysis: PRR(Proportional Reporting Ratio)やROR(Reporting Odds Ratio)の自動計算
- Temporal Pattern Analysis: 時間的パターンの変化による新規シグナルの検出
- 多変量解析: 複数の要因を同時に考慮したシグナル評価
導入時の考慮事項
データ品質とバリデーション
AI活用の成功は、入力データの品質に大きく依存する。以下の点に注意が必要である。
- データの標準化: 異なるソースからの情報を統一フォーマットに変換
- 医学的妥当性: 医学専門家による学習データの品質確認
- 継続的な品質監視: システム運用後の予測精度の定期的評価
規制要件への対応
安全性情報処理における AI活用では、規制要件への適合が重要である。
- Good Pharmacovigilance Practice(GVP)への準拠
- データインテグリティ: ALCOA+原則(Attributable, Legible, Contemporaneous, Original, Accurate + Complete, Consistent, Enduring, Available)の遵守
- 監査証跡: AIによる判定プロセスの記録と追跡可能性の確保
人間とAIの協働
完全自動化ではなく、人間の専門知識とAIの効率性を組み合わせたハイブリッドアプローチが推奨される。
- Human-in-the-loop: 重要な判定には必ず医学専門家の確認を組み込む
- 説明可能AI: LIME(Local Interpretable Model-agnostic Explanations)やSHAP(SHapley Additive exPlanations)による判定根拠の可視化
- 継続的学習: 専門家のフィードバックを活用したモデルの継続的改善
ROI(投資収益率)の評価指標
AI導入効果を定量的に評価するため、以下の指標を設定する必要がある。
効率性指標
- 処理時間短縮率: 従来手法との比較による作業時間の短縮効果
- 自動化率: 人手による確認が不要となった報告の割合
- コスト削減効果: 人的リソースの最適化による経済効果
品質指標
- 検出精度向上: 重要な安全性シグナルの見落とし率の減少
- 報告品質向上: 規制当局からの問い合わせ件数の減少
- コンプライアンス向上: 報告期限遵守率の改善
今後の展望
リアルワールドデータとの統合
電子カルテ、レセプトデータ、ウェアラブルデバイスからのデータとの統合により、より包括的な安全性監視が可能となる。
国際協調の促進
ICH(International Council for Harmonisation)におけるAI活用ガイドライン策定により、グローバルな標準化が進展すると予想される。
プロアクティブな安全性監視
予測モデルの高度化により、有害事象の発生を事前に予測し、予防的措置を講じることが可能となる。
規制科学との連携
規制当局との協働により、AI活用による安全性評価手法の科学的妥当性の確立が進む。
まとめ
苦情・副作用報告処理におけるAI活用は、従来の手法では困難であった大量データの高速・高精度な処理を可能にする。自然言語処理による情報抽出、機械学習による自動トリアージ、深層学習による因果関係評価など、多様なAI技術が安全性監視業務の効率化と品質向上に貢献している。
しかし、その導入には適切なデータ管理、規制要件への対応、人間とAIの協働体制の構築などが重要である。医学的専門知識とAI技術の融合により、患者安全性の更なる向上と、製薬企業の競争力強化の両立が期待される。
技術の進歩とともに、より高度で予測的な安全性監視システムの構築が期待される中、医薬品業界全体の安全性管理レベルの向上に大きく貢献するものと考えられる。





この記事へのコメントはありません。