次世代の電子化CTD:生成AIとブロックチェーンの統合
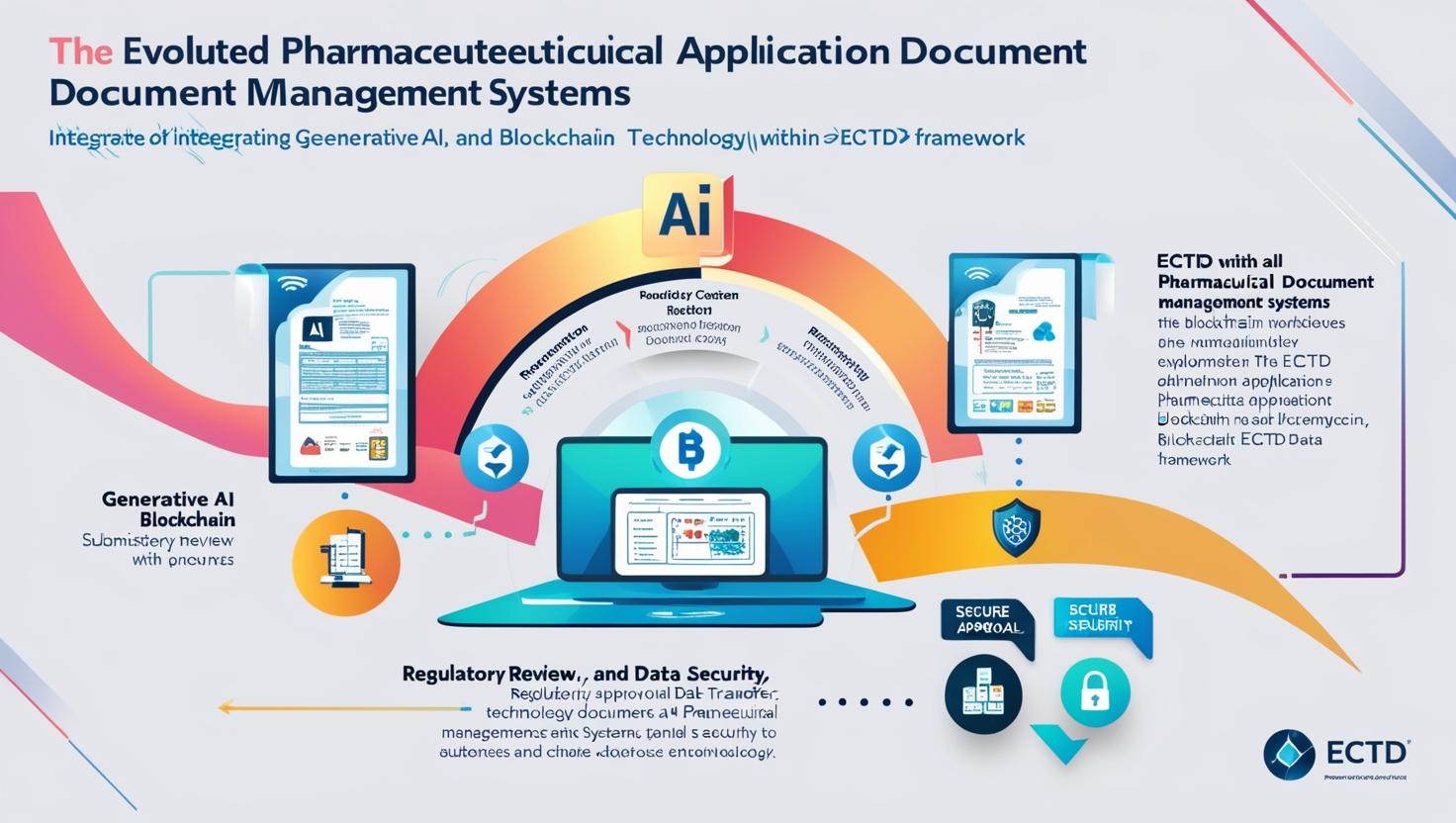
申請文書の次世代管理システムの設計と実装
はじめに
医薬品業界において、規制当局への申請文書は製品承認に至る最も重要なプロセスである。近年、eCTD(electronic Common Technical Document)による電子化が進展する中、生成AI(Generative AI)とブロックチェーン技術の統合により、申請文書管理システムは革新的な進化を遂げようとしている。本コラムでは、これらの先進技術を活用した次世代システムの設計思想と実装手法について、専門用語を交えながら分かりやすく解説する。
現行のeCTDシステムの課題
データ整合性の確保困難
従来のeCTDシステムでは、複数の部門や外部機関が作成した文書を統合する際、データの一貫性(Data Integrity)を保つことが困難である。特に、臨床データ管理システム(CDMS: Clinical Data Management System)、安全性データベース、品質管理文書が個別に管理されているため、情報の齟齬が生じやすい。
文書作成の効率性問題
申請文書の作成には膨大な時間とリソースが必要である。特に、Common Technical Document(CTD)の各モジュール間での情報の重複記載や、規制要件に応じた文書フォーマットの調整は、大きな負担となっている。
トレーサビリティの限界
現行システムでは、文書の変更履歴管理や承認プロセスの透明性に限界がある。FDA 21 CFR Part 11やICH E6(R2)で求められる電子記録の完全性を確保するには、より高度な仕組みが必要である。
生成AIの活用による文書作成の革新
自然言語処理による自動文書生成
大規模言語モデル(LLM: Large Language Model)を活用することで、以下のような文書作成支援が可能となる。
テンプレート自動生成: 規制ガイドライン(ICH M4、FDA Guidance等)に基づき、申請区分や製品特性に応じた最適な文書構造を自動生成する。トランスフォーマーアーキテクチャを基盤とした生成AIにより、規制要件の変更にも動的に対応可能である。
データ要約の自動化: 臨床試験データベースから統計解析結果を抽出し、臨床概要(Clinical Overview)や臨床要約(Clinical Summary)を自動生成する。自然言語生成(NLG: Natural Language Generation)技術により、数値データを規制当局が求める文章形式に変換する。
多言語対応: 機械翻訳技術との組み合わせにより、各国規制当局の要求言語での申請文書を効率的に作成する。特に、日英翻訳における医薬専門用語の正確性向上が期待される。
品質保証の自動化
文書品質チェック: AIによる自動校正機能により、誤字脱字、数値の不整合、引用文献の欠落等を検出する。機械学習アルゴリズムにより、過去の指摘事項パターンを学習し、潜在的な問題を事前に発見する。
規制適合性検証: 各国の規制要件データベースと照合し、申請文書が当該地域の要求事項を満たしているかを自動判定する。Rule-based AIとMachine Learning を組み合わせたハイブリッド手法により、高精度な適合性判定を実現する。
ブロックチェーン技術による文書管理の信頼性向上
不変性とトレーサビリティの確保
ハッシュ値による完全性保証: 各文書にSHA-256ハッシュ値を付与し、ブロックチェーン上に記録することで、文書の改ざんを完全に防止する。分散型台帳技術(DLT: Distributed Ledger Technology)により、中央管理者なしで文書の真正性を証明可能である。
スマートコントラクトによる承認プロセス: 事前に定義された承認ルールをスマートコントラクトとして実装し、文書の承認プロセスを自動化する。Multi-signature機能により、複数の承認者による電子署名を効率的に管理する。
プライベートブロックチェーンの採用
医薬品申請文書の機密性を考慮し、Hyperledger FabricやR3 Cordaなどのプライベートブロックチェーンプラットフォームを採用する。Permissioned Networkにより、認可された参加者のみがネットワークにアクセス可能となる。
コンセンサス機構の最適化: 医薬品業界の特性に適したコンセンサス機構として、Practical Byzantine Fault Tolerance(pBFT)を採用し、高いセキュリティと処理性能を両立する。
システムアーキテクチャの設計
マイクロサービス・アーキテクチャの採用
次世代eCTDシステムは、以下のマイクロサービスで構成される。
文書生成サービス: 生成AIエンジンを統合し、各種申請文書の自動生成を行う。RESTful APIにより他サービスとの連携を図る。
ブロックチェーン管理サービス: 文書の登録、検証、履歴管理をブロックチェーン上で実行する。Event-driven アーキテクチャにより、リアルタイムでの状態更新を実現する。
データ統合サービス: CDMS、安全性データベース、品質管理システム等の既存システムとのデータ連携を担う。ETL(Extract, Transform, Load)処理により、データの正規化と統合を行う。
API Gatewayによる統合管理
各マイクロサービスへのアクセスをAPI Gatewayで一元管理し、認証・認可、レート制限、ログ収集等の横断的機能を提供する。OAuth 2.0 / OpenID Connectによる認証基盤を構築し、セキュアなアクセス制御を実現する。
セキュリティとプライバシーの考慮事項
ゼロトラスト・セキュリティモデル
「信頼しない、常に検証する」の原則に基づき、ネットワーク境界に依存しないセキュリティ体系を構築する。
多要素認証(MFA): 生体認証、デジタル証明書、ワンタイムパスワードを組み合わせた強固な認証機能を実装する。
動的アクセス制御: ユーザーの役割、アクセス時間、地理的位置等のコンテキスト情報に基づく動的な権限制御を行う。Attribute-Based Access Control(ABAC)モデルを採用し、きめ細かいアクセス制御を実現する。
データ暗号化とキー管理
End-to-End暗号化: 文書の保存から転送まで、すべての段階でAES-256による暗号化を実施する。Transport Layer Security(TLS 1.3)により、通信経路の暗号化を確保する。
Hardware Security Module(HSM): 暗号化キーの生成、保存、管理をハードウェアレベルで実行し、最高レベルのセキュリティを確保する。FIPS 140-2 Level 3準拠のHSMを採用する。
実装における技術的考慮事項
生成AIモデルの最適化
Fine-tuning戦略: 医薬品申請文書の特性に合わせて、事前学習済みモデルをファインチューニングする。Transfer Learningにより、限られたドメイン固有データでも高精度なモデル構築が可能である。
Retrieval-Augmented Generation(RAG): 外部知識ベース(規制ガイドライン、過去の申請文書等)を参照しながら文書を生成するRAG手法を採用し、生成内容の正確性と関連性を向上させる。
ブロックチェーンのスケーラビリティ対策
レイヤー2ソリューション: メインチェーンの負荷を軽減するため、State ChannelやSidechainを活用したレイヤー2ソリューションを導入する。
データ圧縮とオフチェーン保存: 大容量文書はIPFS(InterPlanetary File System)等の分散ストレージに保存し、ブロックチェーンにはハッシュ値のみを記録することで、ストレージ効率を向上させる。
ROI評価と導入効果
定量的効果指標
文書作成時間の短縮: 生成AIによる自動化により、従来比70%の時間短縮を実現。年間で約2,000時間の工数削減効果が期待される。
品質向上による承認期間短縮: AI品質チェックにより、規制当局からの照会回数を50%削減。結果として承認取得期間を平均3ヶ月短縮する。
コンプライアンス強化: ブロックチェーンによる完全な監査証跡により、規制監査への対応時間を80%削減する。
定性的効果
ナレッジマネジメントの向上: 過去の申請データと知見をAIが学習することで、組織全体の申請ノウハウが蓄積・継承される。
グローバル展開の加速: 多言語対応と各国規制要件の自動適合により、国際展開のスピードが向上する。
今後の展望と課題
規制対応の進化
デジタル規制への適応: FDA の Electronic Submissions Gateway(ESG)やEMA の IRIS Platform等、規制当局のデジタル化進展に合わせたシステム拡張を継続する。
Real World Evidence(RWE)の統合: 市販後データや電子健康記録(EHR)データをAIで解析し、申請文書への統合を自動化する。
技術的発展への対応
量子耐性暗号への移行: 将来の量子コンピュータ脅威に備え、Post-Quantum Cryptography(PQC)への段階的移行を計画する。
Federated Learning の活用: 複数の製薬企業間でデータを共有せずにAIモデルを共同学習する連合学習技術により、業界全体の知見を活用した高精度システムの構築を目指す。
まとめ
次世代の電子化CTDシステムは、生成AIとブロックチェーン技術の統合により、医薬品申請プロセスの効率性、信頼性、透明性を飛躍的に向上させる。しかし、その実現には技術的課題だけでなく、規制対応、セキュリティ確保、組織変革等、多面的な取り組みが必要である。
これらの先進技術を適切に活用することで、製薬業界は従来の文書中心のアプローチから、データドリブンで自動化された次世代の申請プロセスへと変革を遂げることができる。技術革新が医薬品の迅速な市場投入を可能にし、最終的には患者への医療アクセス向上に貢献するものと期待される。
システム導入に際しては、段階的なアプローチを取り、小規模なパイロットプロジェクトから開始して、組織の習熟度に応じてスケールアップしていくことが成功の鍵となるであろう。

は-450x450.jpg)
は、-450x450.jpg)


この記事へのコメントはありません。